SOCIAL
CONTATTI
Biologa Nutrizionista
Microbiota e farmaci
La nostra è una società che fa sempre più uso di farmaci: sono molte le categorie e le vie di assunzione scelte. Sicuramente, la somministrazione orale è la più frequente, nonché la più semplice. Il farmaco raggiunge lo stomaco, poi l’intestino (tenue e crasso) dove avviene il suo assorbimento e, attraverso il circolo sanguigno, raggiunge il fegato per essere metabolizzato. I prodotti di questa trasformazione possono essere eliminati, attraverso i reni, nelle urine oppure possono essere rimandati, grazie all’azione dei sali biliari, verso l’intestino.
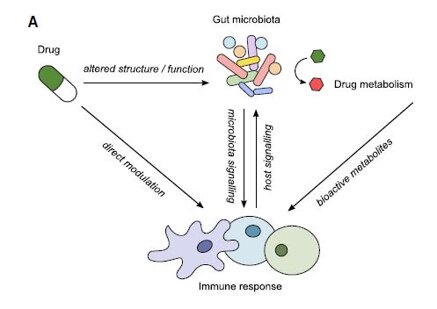
Considerato il “percorso” di queste sostanze, si nota che la loro permanenza nell’intestino è piuttosto prolungata. Di conseguenza, non si può ignorare l’interazione tra di esse e il microbiota intestinale.
Il microbiota non è semplicemente una comunità microbica che vive nell’ospite, ma stabilisce con esso delle relazioni strette: tra di loro, si instaura una convivenza vantaggiosa per entrambi.
Negli ultimi anni, sono stati fatti studi che hanno evidenziato la capacità del microbiota, in particolare quello intestinale (il più abbondante), di interferire con l’efficacia di un trattamento farmacologico. Si è visto che alcuni principi attivi di farmaci vengono metabolizzati da specie batteriche determinando la diminuzione dell’efficacia del trattamento; per contro, alcune di queste interazioni hanno causato il potenziamento dell’effetto terapeutico.
Gli studi sono ancora in fase iniziale, ma qual è la loro importanza? Il primo pensiero viene rivolto ai casi in cui l’attività del microbiota riduce l’azione del farmaco, come ad esempio accade con la gemcitabina (usato in ambito oncologico): i batteri che possono contaminare le cellule cancerose possono anche determinare la loro resistenza a questo farmaco antineoplastico. Succede il contrario con una nota e molto usata categoria di farmaci, gli antinfiammatori non steroidei (FANS): alcuni batteri del microbiota, utilizzando un loro enzima (β-glucuronidasi), sono in grado di riattivare i principi attivi nell’intestino, rendendo vana la detossificazione nel fegato. Un altro caso è rappresentato dalla riduzione delle biodisponibilità del farmaco; ne è un esempio Enterococcus faecalis, batterio che converte L-DOPA in dopamina nell’intestino, prima che essa superi la barriera ematoencefalica.
La correlazione farmaci-microbiota non si esprime solo in un senso, bensì è reciproca, cioè anche i farmaci sono in grado di influenzare il microbiota. È stato, infatti, dimostrato che alcuni principi attivi possono modificare la sua composizione favorendo la crescita di alcune specie a discapito di altre.
Diverse variabili sono state evidenziate: la diversa risposta del microbiota ex vivo e in vivo (cioè i batteri in coltura si comportano diversamente rispetto a quando sono all’interno dell’organismo); le interazioni dei batteri non con singoli farmaci, ma con una combinazione di essi; l’ecosistema microbico (cioè le condizioni ambientali in cui crescono i microbi).
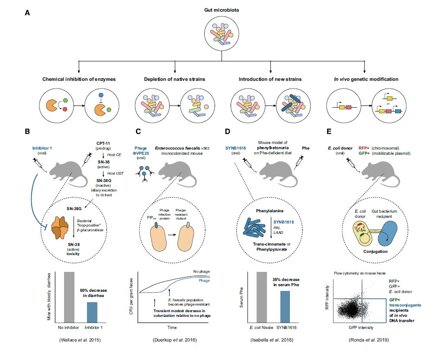
Capire quali sono i meccanismi attraverso i quali tutto ciò accade è molto importante, tanto da creare una nuova branca di studio, la farmacomicrobica. Per assicurare il successo dei trattamenti terapeutici e per poter modulare il microbica intestinale sono state ipotizzate diverse strategie: eliminazione di ceppi batterici (anche mediante l’uso di batteriofagi); introduzione di specie benefiche o di specie ingegnerizzate (usando plasmidi o sequenze mutate) e loro colonizzazione; manipolazione genica dei batteri all’interno dell’ospite; inibizione dell’attività di alcuni enzimi microbici. Oltre a queste prettamente laboratoriali, è auspicabile anche considerare, quale strumento si studio e applicativo, l’alimentazione, visto che è ormai assodato che può modificare la composizione del microbiota intestinale.
La ricerca in questo ambito deve proseguire e, vista la complessità, sarebbe opportuno effettuarla in un’ottica multidisciplinare: si potrebbe arrivare così alla tanto desiderata medicina personalizzata!
Bibliografia:
- “Precision Medicine Goes Microscopic: Engineering the Microbiome to Improve Drug Outcomes”; Kathy N. Lam, Margaret Alexander, and Peter J. Turnbaugh; 2019, Cell Host & Microbe 26, July 10
- “Personalized Mapping of Drug Metabolism by the Human Gut Microbiome”; Javdan et al.; 2020, Cell 181, 1661–1679
SOCIAL
CONTATTI
Biologa Nutrizionista